药物的消除半衰期(t½)在药代动力学中,被定义为药物在体内的浓度或总量降低一半所需的时间。这个参数是血药浓度-时间曲线(C-tcurve)分析中的一个核心指标。一条典型的C-t曲线描绘了药物经吸收、分布、代谢、排泄(ADME)全过程后,血浆中药物浓度随时间的变化情况。半衰期主要反映了药物从体内消除(代谢和排泄)的速率。一个简短的半衰期意味着药物被机体快速清除,反之则意味着清除缓慢。
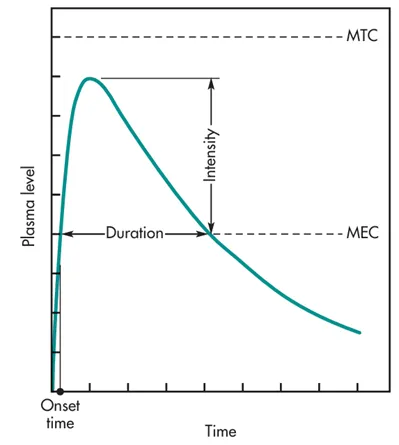
图1 口服给药一般的药时曲线
在临床前或临床研究中,通过对不同时间点采集的血样进行分析,可以绘制出完整的血药浓度-时间曲线,并从中计算出半衰期、达峰浓度(Cmax)、达峰时间(Tmax)和曲线下面积(AUC)等关键PK参数。这些数据是后续制剂设计的基础和依据。通常,为了获得完整的曲线,采样时间需要持续3-5个半衰期。
1半衰期为何是制剂设计的关键锚点
半衰期在制剂设计中占据核心地位,理论上,为了维持血药浓度在有效治疗窗(即最低有效浓度MEC和最低中毒浓度MTC之间)内,给药间隔应约等于药物的半衰期。这意味着短半衰期药物需要频繁给药,而长半衰期药物则可以实现较长的给药间隔。频繁给药不仅降低了患者的依从性,还容易导致血药浓度的剧烈波动——在给药后出现过高的峰浓度(Cmax),可能引发毒副作用;而在下次给药前出现过低的谷浓度,可能导致疗效不足。对于天然半衰期不理想的药物,制剂科学的目标就是通过技术手段“修饰”或“重塑”其在体内的释放行为,从而人为地延长其作用时间,实现更理想的给药方案。这正是缓释、控释、长效制剂等特殊递送系统发挥作用的核心场景。因此,拿到一个候选化合物的半衰期数据,是制剂科学家开启配方设计之旅的第一步。
2.基于不同半衰期范围的制剂设计总体策略
根据半衰期的长短,我们可以将药物大致分为三类,并采用截然不同的制剂设计策略,当然了分类仅供参考,实际设计中需结合药效学与临床需求。
2.1短半衰期药物(t½<4-6小时)的挑战与对策
短半衰期药物是制剂开发中最常遇到也最具挑战性的情况。一天需要给药3-4次甚至更多,患者依从性极差,尤其对于需要长期治疗的慢性病(如高血压、糖尿病)而言,这是一个巨大的障碍。典型的“峰谷”现象明显,增加了Cmax相关的毒性风险和谷浓度时“药物假期”导致的疗效丧失风险。患者夜间无法按时服药,导致治疗效果中断。延长作用时间,实现“降频增效”。针对短半衰期药物,制剂设计的首要目标是将其开发成缓释或控释制剂,以减少给药频率至每日一次或两次。
口服缓控释制剂(Oral Sustained/Controlled-Release Formulations):这是最常用和最成熟的策略。
骨架型缓释片:将药物与高分子材料(如HPMC)混合压片,药物通过溶蚀或扩散缓慢释放。
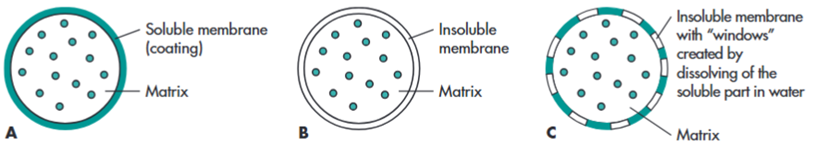
图2 三种不同类型的修饰性基质释放机制示例。
膜控型缓释制剂:将药物制成丸芯,再包上一层不溶或半透的高分子膜,通过膜上的微孔或渗透压来控制药物释放速率。渗透泵片是其中的高精尖代表。
微丸或微球系统(Microspheres):将药物制成微小的球状颗粒,再填充到胶囊或压成片剂。这些微球本身可以是骨架型或膜控型,能够实现平稳的药物释放。这种剂型在胃肠道中分散广,受食物影响小,个体差异小。
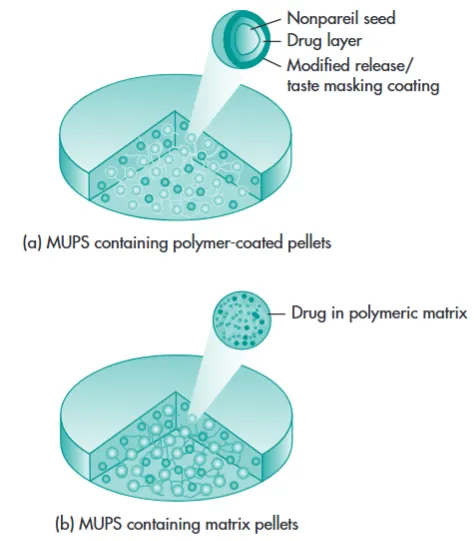
图3 多单元微丸系统(MUPS)片剂类型示意图——(a) 由包衣微丸组成,(b) 未包衣/基质微丸。
长效注射剂(Long-Acting Injectables ,LAI):对于需要通过注射给药的短半衰期药物(如多肽、蛋白质),或者为了实现更长给药周期(如一周、一月甚至数月)的药物,LAI是理想选择。
聚合物微球/原位凝胶:将药物包裹在可生物降解的聚合物(如PLGA)微球中,注射后微球在体内缓慢降解释放药物。或者注射一种液体,在体内形成凝胶储库,缓慢释放药物。
油性注射液/混悬剂:利用药物在油相中的低溶解度或制成结晶混悬液,延缓药物从注射部位的吸收。
透皮给药系统(Transdermal Delivery Systems ,TDS):如果药物的理化性质(如分子量小、亲脂性适中、日剂量小)合适,可以设计成透皮贴剂。贴剂能够以接近零级速率的方式,连续数日向血液循环中输送药物,提供极其平稳的血药浓度,完美解决了短半衰期药物的难题。
最后需要强调,当你打算为一个半衰期短的药物开发缓释制剂时,第一步必须是判断它的短半衰期是由“快速消除”还是“慢速吸收”引起的。如果是快速消除,那么缓释技术是对症下药的正确策略。如果是慢速吸收,那么缓释技术可能就是雪上加霜的危险操作。此时,制剂科学家首先应该考虑的是如何改善药物的吸收(例如通过增溶、使用吸收促进剂、改变给药途径等),而不是进一步去延缓它。
案例分享:盐酸哌甲酯缓释片(Concerta®)
盐酸哌甲酯是一种中枢神经系统兴奋剂,适用于治疗注意缺陷多动障碍(ADHD),常用于6岁及以上的儿童。哌甲酯口服后吸收迅速,消除半衰期约为3.5小时。
盐酸哌甲酯缓释片(Concerta)包含一个具有渗透活性的控释核心和一层速释药物外衣。该产品利用渗透压以可控速率递送盐酸哌甲酯。此系统外观与普通片剂相似,由一个渗透活性的三层核心、包裹其的半透膜以及一层速释药物外衣组成。三层核心包含两个含药物及辅料的药物层和一个含渗透活性成分的推动层。
本品为每日一次口服给药的缓释片剂,含有18、27、36或54 mg USP标准盐酸哌甲酯,设计有效时长为12小时。口服Concerta后,血浆哌甲酯浓度迅速上升,约1小时达到首次峰值,随后在接下来的5至9小时内浓度逐渐升高,之后开始逐渐下降。平均达峰时间出现在服药后6至10小时。
当患者在早晨服用此产品时,会先获得一个初始负荷剂量,随后是维持剂量。由于药物具有较短的消除半衰期,其在傍晚患者需要入睡时已基本消除,因此不会在体内产生蓄积。
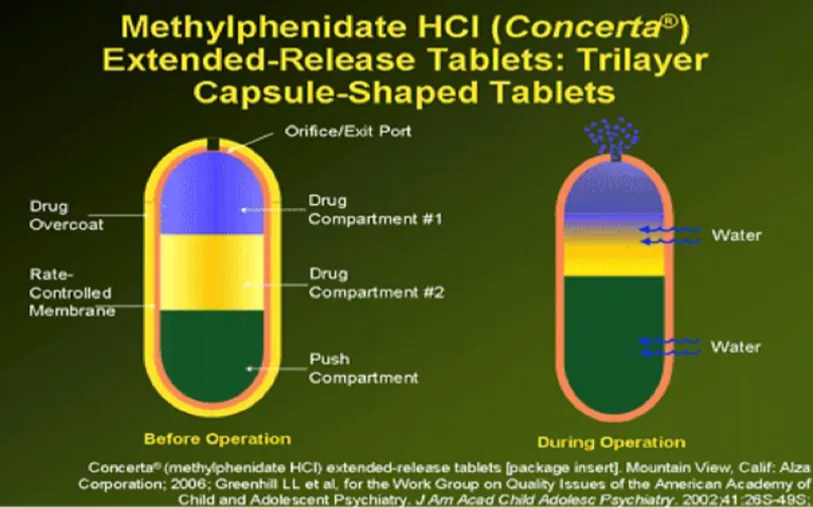
图4 盐酸哌甲酯缓释片(Concerta®)制剂设计
2.2中等半衰期药物(t½≈8-12小时)的制剂设计考量
这类药物的半衰期使其天然适合每日一到两次的给药方案,因此制剂设计的重点有所不同。虽然每日两次是可接受的,但每日一次的方案无疑能进一步提升患者依从性。保证生物利用度,确保药物能够被充分、稳定地吸收是首要任务。针对特定治疗需求,可能需要快速起效或与其他药物联用。
制剂设计对策经常是常规与优化并举,如常规速释制剂(Immediate-Release Formulations)是最基础的选择,如普通片剂或胶囊。制剂工作的核心在于解决药物的溶解度和渗透性问题,以确保其生物利用度。这需要充分考虑化合物的pKa、溶解度、稳定性等理化性质。例如,对于溶解度差的药物,可能需要采用微粉化、制成盐、或开发成固体分散体等技术来增溶;每日一次的缓释制剂将每日两次的给药方案优化为每日一次,可以显著提高患者的生活质量。此时,不需要像短半衰期药物那样复杂的控释技术,可能一个简单的亲水凝胶骨架片就足以将其作用时间延长至24小时。
优化型剂型,如口腔崩解片(ODT),无需用水即可在口中迅速崩解,方便吞咽困难的儿童或老年患者;复方制剂(FDC),将此药物与另一个治疗相关药物(可能具有不同半衰期)组合在同一片剂中,简化治疗方案;对于治疗窗窄的中等半衰期药物,也可考虑控释制剂以平稳血药浓度。
2.3长半衰期药物(t½>24小时)的挑战与对策
长半衰期药物在给药频率上具有天然优势,但同时也带来了新的挑战。连续给药时,由于消除缓慢,药物容易在体内蓄积,导致血药浓度逐渐升高,最终可能超过中毒浓度(MTC),引发毒副作用。需要经过多个半衰期(通常是4-5个t½)才能达到稳态血药浓度,对于需要快速起效的疾病来说可能无法满足需求。一旦发生严重不良反应,由于药物在体内清除缓慢,不良反应会持续很长时间。
制剂设计对策一般是侧重安全性、快速起效与精准控制。
常规速释制剂结合给药方案调整:对于大多数长半衰期药物,常规的速释片剂或胶囊是标准选择。其挑战不在于剂型本身,而在于给药方案的设计。
负荷剂量(Loading Dose):为了快速达到稳态浓度,可以在治疗开始时给予一个或数个较高的初始剂量,随后转为较低的维持剂量。制剂上可以开发不同规格的片剂来配合这种方案。
避免进一步缓释:通常不推荐将长半衰期药物开发成缓释剂型,因为这会进一步加剧药物蓄积的风险,导致不可控的毒性。
靶向递送系统(Targeted Delivery):对于一些毒性较大的长半衰期药物(如某些抗癌药),尽管其半衰期很长,但全身暴露仍然是有害的。此时,制剂设计的方向是“空间选择性”而非“时间控制”。可以利用脂质体、纳米粒、抗体-药物偶联物(ADC)等载体,将药物主动或被动地靶向递送至病变组织或器官。这样可以在不影响全身半衰期的情况下,提高病灶部位的药物浓度,同时显著降低在健康组织中的暴露,从而“解耦”疗效与全身毒性。靶向系统可能改变药物的PK特性,需重新评估其半衰期与给药方案。
3.制剂设计中必须综合考量的其他关键因素
半衰期是制剂设计的起点,但绝非终点。一个成功的制剂方案,必须是多维度因素综合平衡的结果。
3.1化合物的理化性质:药物的溶解度、pKa、渗透性、稳定性、分子量等是剂型设计的根本制约因素。例如,一个水溶性极差的药物,即使半衰期很短,也难以制成简单的口服缓释片,因为释放出的药物无法溶解,也就无法吸收。此时可能需要先通过增溶技术(如制成纳米混悬剂)再结合缓释技术。同样,大分子药物(如蛋白质)通常无法口服,也难以透皮吸收,其制剂设计路线基本被限定在注射给药。
3.2给药途径与生物利用度:选择何种给药途径(口服、注射、透皮、吸入等)直接影响制剂设计的技术平台。口服给药方便,但面临胃肠道降解和肝脏首过效应的挑战,这可能导致表观半衰期缩短。对于存在严重首过效应的药物,其口服生物利用度本就低下,若再叠加‘吸收速率限制’,则开发口服缓释制剂的挑战和风险会进一步加剧。而注射给药生物利用度高,但便利性差且需要无菌生产。制剂科学家必须权衡利弊。
3.3治疗窗与毒理学特性:治疗窗窄的药物,对血药浓度的平稳性要求极高。即使其半衰期中等,也通常需要开发成控释制剂,以精确地将血药浓度维持在狭窄的治疗窗内,避免因微小波动引发的毒性或失效。
3.4适应症与患者群体:药物用于治疗急性病还是慢性病?患者是儿童、成人还是老人?这些临床需求深刻影响剂型选择。例如,用于急救的药物必须是速效剂型(如静脉注射液);而用于老年痴呆症患者的药物,则应优先考虑能提高依从性的长效贴剂或长效注射剂。
4.总结
综上所述,化合物的消除半衰期是药物制剂设计过程中的一个核心导航参数。它像一个指南针,为制剂科学家指明了初步的设计方向:对于短半衰期药物,核心任务是通过缓释、控释技术“延长”药物的作用时间,将频繁给药转变为每日一次或更低频率的便捷方案。对于中等半衰期药物,重点在于优化吸收和提升便利性,可以在速释和适度缓释之间灵活选择。对于长半衰期药物,关键在于控制蓄积风险,确保用药安全,剂型上通常选择速释制剂,并配合给药方案的调整,或在特定情况下采用靶向递送策略。
然而,必须强调,制剂设计是一门“平衡的艺术”。半衰期不能孤立地作为唯一决策依据。最终的制剂方案,必然是综合考量了药物的理化性质、预期的给药途径、药理与毒理特性以及最终的临床需求等多方面因素后,做出的最优选择。未来的药物递送系统将更加智能化和个性化,但深刻理解并善用半衰期这一基本药代动力学原理,将永远是所有复杂制剂设计工作的基石。
参考资料
1.Applied Biopharmaceutics &Pharmacokinetics 19 Modified-Release Drug Products and Drug Devices
2.https://www.accessmhct.com/wp-content/uploads/2021/01/ADHD-201-v.1.7.2021.pptx
转载药事纵横公众号